Sulfat de calciu
În acest articol vom analiza și aprofunda subiectul Sulfat de calciu. De-a lungul anilor, Sulfat de calciu a fost subiect de studiu și interes pentru mulți oameni din diverse domenii. De la psihologie la astronomie, prin istorie, literatură și sociologie, Sulfat de calciu a fost un subiect recurent și relevant. În acest articol, ne propunem să explorăm diferite aspecte ale Sulfat de calciu, de la origini până la influența sa asupra societății actuale. Vom analiza impactul acestuia asupra culturii, științei, artei și vieții de zi cu zi, căutând să înțelegem profund și complet importanța sa în lumea de astăzi.
| Sulfat de calciu | |
 | |
 | |
| Denumiri | |
|---|---|
| Identificare | |
| Număr CAS | 7778-18-9 |
| ChEMBL | CHEMBL2106140 |
| PubChem CID | 24497 |
| Informații generale | |
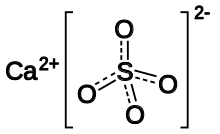
| Formulă chimică | CaSO4 |
| Masă molară | 135,91432046 u.a.m. |
| Proprietăți | |
| Densitate | 2,96 g/cm³[2] |
| Punct de topire | 1.450 °C[3] |
| Solubilitate | 0,3 g/100 g[2] |
| Presiune de vapori | 0 mm Hg[2] |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Sulfatul de calciu este o sare a calciului cu acidul sulfuric cu formula chimică CaSO4. Este totodată un compus cu o mare importanță industrială.
Este insolubil în apă. Se găsește în natură sub forma de dihidrat (gips) și anhidru (anhidrit sau ipsos). Gipsul se transformă prin încălzire la 120-140°C în ipsos. În industrie este folosit în construcții iar în medicină pentru realizarea aparatelor de imobilizarea a fracturilor.
- ^ „Sulfat de calciu”, CALCIUM SULFATE (în engleză), PubChem, accesat în
- ^ a b c http://www.cdc.gov/niosh/npg/npgd0095.html Lipsește sau este vid:
|title=(ajutor) - ^ Basic laboratory and industrial chemicals: A CRC quick reference handbook Verificați valoarea
|titlelink=(ajutor)