Acid sulfuros
În acest articol, vom explora subiectul Acid sulfuros în profunzime, analizând originile, evoluția, impactul și posibilele perspective de viitor ale acestuia. Acid sulfuros a fost subiect de interes și dezbatere de-a lungul istoriei, influențând diverse aspecte ale societății, culturii și politicii. Pe parcursul secțiunilor următoare, vom aprofunda în sensul său, implicațiile și relevanța sa în contextul actual, aruncând lumină asupra diferitelor fațete care alcătuiesc acest fenomen. În plus, vom examina diferite abordări și opinii pentru a oferi o viziune cuprinzătoare și echilibrată, oferind cititorului o înțelegere mai largă și mai profundă a Acid sulfuros.
| Acid sulfuros | |
 Model 3D | |
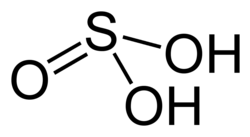 | |
| Denumiri | |
|---|---|
| Alte denumiri | Dihidrogensulfit |
| Identificare | |
| Număr CAS | 7782-99-2 |
| ChEMBL | CHEMBL1161699 |
| PubChem CID | 1100 |
| Informații generale | |
| Formulă chimică | H2SO3 |
| Aspect | Lichid incolor, inodor, insipid |
| Masă molară | 82,07 g/mol |
| Proprietăți | |
| Densitate | 1,8356 g cm−3, lichid 1,266 g cm−3, solid |
| Solubilitate | miscibil în apă [2] |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Acidul sulfuros, H2SO3, este un activ acid mineral anorganic. E un compus instabil și se găsește numai în soluție apoasă, produsă în momentul dizolvării dintre apă și dioxid de sulf sau combinării dintre hidrogen cu sulfiți.
Sărurile acestui anion se numesc sulfiți, care au formula SO32-
Producere
Acidul sulfuros se poate produce prin reacția dioxidului de sulf cu apa.
Referințe
- ^ „Acid sulfuros”, Sulfurous acid (în engleză), PubChem, accesat în
- ^ en Accesat la 23 martie 2012 http://gestis-en.itrust.de/nxt/gateway.dll?f=id$t=default.htm$vid=gestiseng:sdbeng$id=005670
Bibliografie
- C. D. Nenițescu, Chimie generală
- Constantin D. Albu, Maria Brezeanu, Mică enciclopedie de chimie, Editura Enciclopedică Română, 1974, p 26