Etenă
În acest articol, vom explora Etenă în profunzime, analizând impactul, relevanța și influența acestuia în diverse domenii. Etenă a devenit un subiect de interes din ce în ce mai mare în societatea de astăzi, generând dezbateri și reflecție în jurul implicațiilor sale. Pe parcursul acestor pagini, vom examina multiplele aspecte care înconjoară Etenă, de la originea și dezvoltarea sa până la evoluția sa în timp. În plus, vom analiza legătura ei cu alte fenomene și rolul său în modelarea lumii actuale. Sperăm că acest articol să servească drept punct de plecare pentru o reflecție mai profundă asupra Etenă și implicațiile sale pentru viața de zi cu zi.
| Etenă | |
 | |
 | |
 | |
| Denumiri | |
|---|---|
| Alte denumiri | Etilenă |
| Identificare | |
| Număr CAS | 74-85-1 |
| ChEMBL | CHEMBL117822 |
| PubChem CID | 6325 |
| Informații generale | |
| Formulă chimică | C2H4 |
| Aspect | gaz incolor |
| Masă molară | 28,05 g/mol |
| Proprietăți | |
| Densitate | 1,178 kg/m3 (la 15 °C) |
| Starea de agregare | gaz |
| Punct de topire | −169,2 °C |
| Punct de fierbere | −103,7 °C |
| Solubilitate | în etanol: 4,22 mg/L |
| Aciditate (pKa) | 44 |
| NFPA 704 | |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
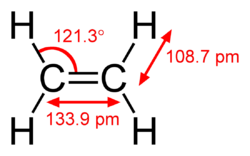
Etena sau etilena este cea mai simplă alchenă și are formula chimică C2H4 și formula structurală CH2=CH2.
Structură
Această hidrocarbură are patru atomi de hidrogen legați de o pereche de atomi de carboni care sunt la rândul lor legați printr-o legătură dublă. Toți cei șase atomi din molecula de etilenă sunt coplanari.
Este un compus nestabil termodinamic in raport cu elementele componente[1]. Inerția legăturilor chimice este mai mare decât entalpia liberă a reacțiilor de descompunere.
Utilizări

Cele mai importante reacții ale etilenei din punct de vedere industrial sunt: polimerizarea, oxidarea, halogenarea și hidrohalogenarea, alchilarea și oligomerizarea.
Note
- ^ Nenițescu, ediția a VIII-a (1980), p. 157
Bibliografie
- Costin Nenițescu, Chimie Organică, ediția a VIII-a, volumul I, Editura Didactică și Pedagogică, București, 1980
