Metabisulfit de sodiu
În lumea de astăzi, Metabisulfit de sodiu a devenit un subiect de mare relevanță și interes pentru o gamă largă de oameni. De la apariția sa, Metabisulfit de sodiu a generat numeroase discuții și controverse, marcând un punct de cotitură în domeniul _var2. Pe măsură ce lumea avansează și se confruntă cu noi provocări, Metabisulfit de sodiu rămâne o problemă centrală care continuă să capteze atenția experților, autorităților și cetățenilor deopotrivă. În acest articol, vom explora în profunzime diferitele aspecte legate de Metabisulfit de sodiu, impactul acestuia asupra societății actuale și posibilele implicații pentru viitor.
| Metabisulfit de sodiu | |
 | |
 | |
| Identificare | |
|---|---|
| Număr CAS | 7681-57-4 |
| PubChem CID | 656671 |
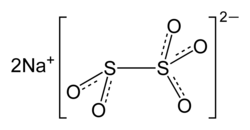
| Formulă chimică | Na₂O₅S₂[1] |
| Masă molară | 189,898254 u.a.m.[1] |
| Proprietăți | |
| Densitate | 1,4 g/cm³[2] |
| Punct de topire | 150 °C |
| Solubilitate | 54 g/100 g[2] |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Metabisulfitul de sodiu (denumit și disulfit sau pirosulfit de sodiu) este un compus anorganic, o sare de sodiu cu formula chimică Na2S2O5. Este utilizat în principal pe post de conservant alimentar, având numărul E E223.[3] Este utilizat și ca dezinfectant și antioxidant.[4]
Obținere
Metabisulfitul de sodiu este obținut în urma reacției dintre hidroxid de sodiu și dioxid de sulf.[5] În mediu apos, la cald, Na2SO3 precipită inițial sub formă de solid galben. Cu exces de SO2, solidul se dizolvă formând disulfitul, care cristalizează prin răcire:[6]
Note
- ^ a b „Metabisulfit de sodiu”, disodium sulfinato sulfite (în engleză), PubChem, accesat în
- ^ a b http://www.cdc.gov/niosh/npg/npgd0566.html Lipsește sau este vid:
|title=(ajutor) - ^ „Lista completa a E-urilor si alimentele in care se gasesc”, Sfatulmedicului.ro, accesat în
- ^ Barberá, José Jiménez; Metzger, Adolf; Wolf, Manfred (), „Sulfites, Thiosulfates, and Dithionitesl Chemistry”, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a25_477
- ^ Catherine E. Housecroft; Alan G. Sharpe (). „Chapter 16: The group 16 elements”. Inorganic Chemistry, 3rd Edition. Pearson. p. 520. ISBN 978-0-13-175553-6.
- ^ Johnstone, H. F. (). „Sulfites and Pyrosulfites of the Alkali Metals”. Inorganic Syntheses. Inorganic Syntheses. 2. pp. 162–167. doi:10.1002/9780470132333.ch49. ISBN 9780470132333.
Legături externe
- Definiție pentru aditivul alimentar „E223” la infocons.ro (denumire și descriere).

